
वीडियो: प्रबल और दुर्बल अम्ल क्या होते हैं उदाहरण सहित समझाइए?
2024 लेखक: Stanley Ellington | [email protected]. अंतिम बार संशोधित: 2023-12-16 00:17
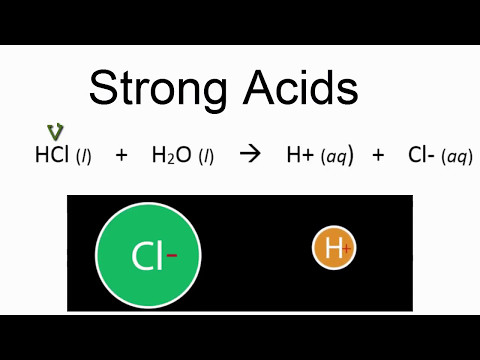
मजबूत अम्ल पानी में पूरी तरह से अलग (अलग हो जाना)। के लिये उदाहरण , एचसीएल, ए मजबूत अम्ल H+ और Cl- आयनों में टूट जाएगा। कमजोर अम्ल आंशिक रूप से पानी में अलग कर देना। के लिये उदाहरण , एचएफ, ए कमजोर अम्ल , किसी भी समय केवल कुछ एचएफ अणु अलग हो जाएंगे।
इस पर विचार करते हुए प्रबल और दुर्बल अम्ल क्या होते हैं उदाहरण दीजिए?
उदाहरण का मजबूत अम्ल हाइड्रोक्लोरिक हैं अम्ल (एचसीएल), परक्लोरिक अम्ल (एचसीएलओ4), नाइट्रिक अम्ल (HNO3) और सल्फ्यूरिक अम्ल (एच2इसलिए4) ए कमजोर अम्ल केवल आंशिक रूप से अलग है, दोनों अविभाजित के साथ अम्ल और इसके पृथक्करण उत्पाद, समाधान में, एक दूसरे के साथ संतुलन में मौजूद हैं। हा हो+ + ए−.
इसी प्रकार, दुर्बल अम्ल क्या होते हैं उदाहरण दीजिए? कमजोर अम्लों का पीएच मान अपेक्षाकृत कम होता है और मजबूत क्षारों को बेअसर करने के लिए उपयोग किया जाता है। कमजोर एसिड के उदाहरणों में शामिल हैं: सिरका अम्ल (सिरका), लैक्टिक एसिड, साइट्रिक एसिड, और फॉस्फोरिक एसिड.
साथ ही, प्रबल अम्ल और दुर्बल अम्ल क्या होते हैं, दो उदाहरण दीजिए?
उदाहरण का मजबूत अम्ल हाइड्रोक्लोरिक शामिल करें अम्ल ( एचसीएल ), सल्फ्यूरिक अम्ल (H2SO4), नाइट्रिक अम्ल (HNO3)… उदाहरण का कमजोर अम्ल शामिल खट्टा /एथेनोइक अम्ल (यानी सिरका में) (CH3COOH), हाइड्रोफ्लोरिक अम्ल (एचएफ), पानी (जिसे हमें याद रखना चाहिए वह उभयधर्मी है) (एच2ओ)…
प्रबल और दुर्बल अम्ल से आप क्या समझते हैं?
ए कमजोर अम्ल एक अम्ल जो एक जलीय घोल या पानी में अपने आयनों में आंशिक रूप से अलग हो जाता है। इसके विपरीत, ए मजबूत अम्ल पानी में अपने आयनों में पूरी तरह से अलग हो जाता है। उसी एकाग्रता में, कमजोर अम्ल से अधिक पीएच मान है मजबूत अम्ल.
सिफारिश की:
दुर्बल अम्ल और प्रबल क्षार क्या उत्पन्न करते हैं?

एक दुर्बल अम्ल और प्रबल क्षार का नमक अतिरिक्त OH- आयन उत्पन्न करने के लिए जल में जल-अपघटन से गुजरता है। चूंकि एसिटिक अम्ल एक दुर्बल अम्ल है, यह विलयन में संघटित रहता है और OH- आयन विलयन को क्षारीय या क्षारीय बनाते हैं। इसी प्रकार प्रबल अम्ल और दुर्बल क्षार का लवण जलीय विलयन में अम्लीय होता है
खाद्य श्रृंखला और खाद्य जाल क्या है उदाहरण सहित समझाइए?

एक खाद्य श्रृंखला केवल एक ही मार्ग का अनुसरण करती है क्योंकि जानवर भोजन पाते हैं। उदाहरण: बाज सांप को खाता है, जिसने मेंढक को खा लिया है, जिसने टिड्डे को खा लिया है, जिसने घास खा ली है। एक खाद्य वेब कई अलग-अलग पथ दिखाता है जो पौधे और जानवर जुड़े हुए हैं। उदाहरण: एक बाज चूहा, गिलहरी, मेंढक या कोई अन्य जानवर भी खा सकता है
सकल घरेलू उत्पाद क्या है उदाहरण सहित समझाइए सकल घरेलू उत्पाद की गणना की विधि?

सकल घरेलू उत्पाद सभी अंतिम वस्तुओं और सेवाओं के बाजार मूल्य की एक वित्तीय ताकत है जो समय-समय पर वितरित की जाती है, अक्सर समय-समय पर। जीडीपी का अनुमान लगाने के लिए सबसे लोकप्रिय तरीका निवेश विधि है: जीडीपी = खपत + निवेश (सरकारी खर्च) + निर्यात-आयात
प्रबल अम्ल और दुर्बल अम्ल क्या है उदाहरण सहित ?

हाइड्रोक्लोरिक एसिड (HCl), परक्लोरिक एसिड (HClO4), नाइट्रिक एसिड (HNO3) और सल्फ्यूरिक एसिड (H2SO4) मजबूत एसिड के उदाहरण हैं। एक दुर्बल अम्ल केवल आंशिक रूप से वियोजित होता है, जिसमें अविभाजित अम्ल और उसके वियोजन उत्पाद दोनों ही विलयन में एक दूसरे के साथ संतुलन में मौजूद होते हैं।
अम्ल प्रबल और तनु कैसे हो सकता है?

सांद्रित और तनु एक विलायक में एक अम्लीय या मूल पदार्थ की सांद्रता को संदर्भित करता है। 16 एम एचसीएल उसी एसिड के 0.5 एम समाधान से अधिक केंद्रित है। मजबूत और कमजोर एक एसिड या बेस के अलग होने की क्षमता को संदर्भित करता है। एक प्रबल अम्ल जल में पूर्णतः वियोजित होकर हाइड्रोनियम आयन बनाता है
